1 原子とイオンh 【原子の構造】 |
||||
 |
||||
|
原子は原子核を中心として,その周りに電子が存在する。さらに,原子核は陽子と中性子からなる。陽子の数は元素によって決まっていて,その数を元素の〔 原子番号 〕という。また,陽子の数と中性子の数を合わせて〔 質量数 〕という。陽子の数と電子の数は等しいので,原子全体では電気的に中性(±0)になっている。上のモデル図の原子は陽子が2個だから〔 He 〕である |
||||
|
原子の電子配置 電子は原子核の周りにいくつかの層に分かれて存在する。この層を〔 電子殻 〕という。電子殻は内側からK殻,L殻,M殻・・・とよんでいる。各電子殻に入る電子の最大数は,K,L,M,・・・をn=1,2,3・・・とすると,〔 2n2 〕個となる。 |
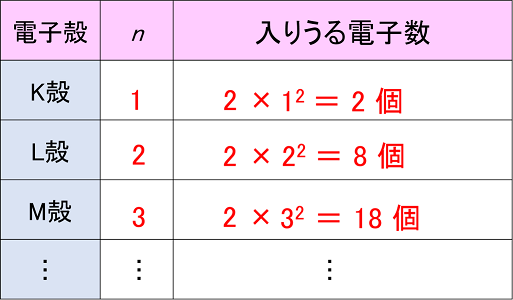 |
|||
|
例)8Oと11Naの電子配置 |
||||
 |
||||
|
19Kや20Caなどの電子配置は基本的には,1H~18Arと同じだが,最も外側の電子殻の配置が異なるので注意する。 |
||||
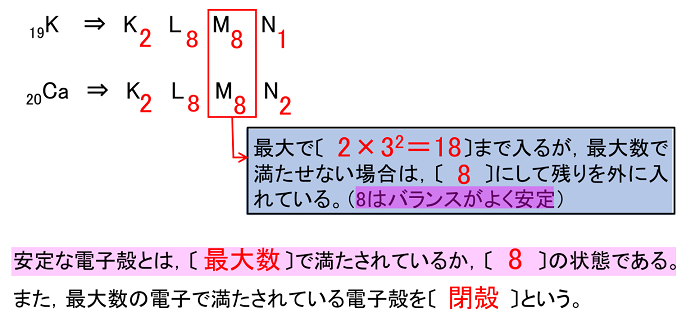 |
||||
|
価電子 原子の最外殻の電子を〔 価電子 〕という。最外殻の電子は,原子が反応したり,結合したりするときに使われる。そのため,価電子の数が同じ原子は化学的性質が似る(左下))。 貴ガス(2He,10Ne,18Ar,36Kr,…)の原子は他の原子と反応したり,結合したりしない。化学的に安定な性質である。希ガスの電子配置を考えてみると,なぜ安定なのかがわかる(右下)。そのため,貴ガスの価電子数は〔 0 〕と示す。最外殻の電子数といった場合は,2や8と示すので注意。他の原子では「価電子数=最外殻の電子数」となる。 |
||||
 |
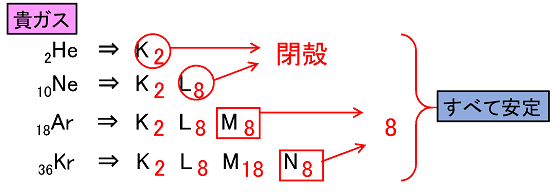 |
|||
|
(1)9F (2)13Al (3)16S (4)18Ar (5)12Mg (1) 最外殻電子7,価電子7 (2) 最外殻電子3,価電子3 (3) 最外殻電子6,価電子6 (4) 最外殻電子8, 価電子0 (5) 最外殻電子2,価電子2 周期表と電子配置 |
||||
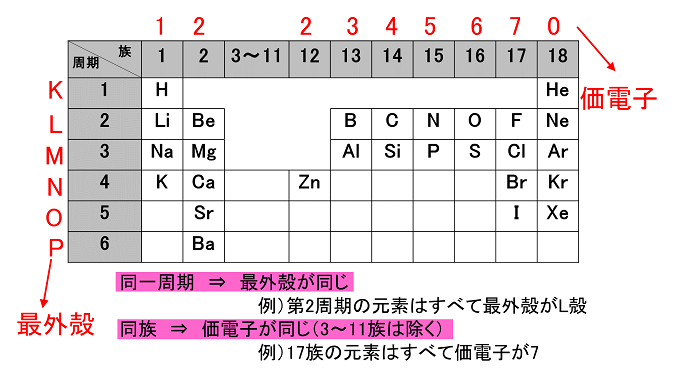 |
||||
|
【イオンの生成】 多くの原子は,不安定で単独では存在できない。安定な原子は,最外殻の電子数が8個(価電子0)の貴ガス元素だけである。そこで不安定な原子は安定化するため,最外殻の電子(-の粒子)を放出したり,受け取ったりして最外殻の電子数が8個(価電子0)の状態になる。この状態がイオンである。最外殻電子が1~3個の原子は,最外殻電子1~3個を放出して,陽イオンになる。最外殻電子が6~7個の原子は,最外殻に電子2~1個を取り込んで,陰イオンになる。また,最外殻電子が4~5個の原子は,イオンにはならず他の方法で安定化する。 |
||||
 |
||||
|
例題 次のa,bにあてはまるものを,それぞれの解答群①~⑤のうちから1つずつ選べ。 a 最外殻電子が最も多い原子 ① 炭素 ② 窒素 ③ ヘリウム ④ ナトリウム ⑤ 酸素 ① Al3+ ② F- ③ Li+ ④ Mg2+ ⑤ O2- a ① 6C 電子配置K2L4より最外殻電子4 ② 7N 電子配置K2L5より最外殻電子5
例題 右の表は周期表の一部である。この中の原子が安定なイオンになったときに,イオン半径が最も大きい元素はどれか。 |
||||
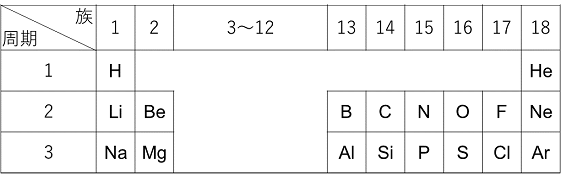 |
||||
イオン半径は,イオンの原子核から最外殻までの長さである。周期表では,周期が増すごとに最外殻がより外側になる。そのため,この周期表の中で最もイオン半径が大きいのは,第3周期のNa~Arのイオンのどれかとなる。Na,Mg,Alは金属元素で最外殻の電子を放出して陽イオンになるので,イオンになると最外殻が1つ内側になる(小さくなる)。Si,Pは最外殻電子がそれぞれ4,5なのでイオンにならない。またArは安定な電子配置なのでイオンならない。S,Clは非金属元素なので,電子をそれぞれ2,1個受け取って陰イオンになり,最外殻はM殻のままなので,この2つのどちらかのイオン半径が最大となる。SとClはそれぞれS2-とCl-のイオンになる。S2-とCl-は原子核に陽子がそれぞれ16(+16),17(+17)あり,ともに電子を18(-18)もっている。電子18個をより多くの陽子で原子核に引き付けているS2-は最外殻がより内側に強く引き付けられているので,Cl-よりもイオン半径が小さくなる。よってイオン半径が最大なのはCl-である。 例題 次の物質の組み合わせで,融点の高いものをそれぞれ答えよ。 ① NaBrとNaCl ② Li2OとNa2O 固体は粒子が互いに引き合って集まった状態である。固体に熱を加えていくと,粒子は熱運動によって動くようなる。粒子間の結合力が強い物質を液体にするにはより多くの熱を必要とする。つまり,融点が高い物質は粒子間の結合力が強いということになる。この場合の粒子間の結合はイオン結合である。イオン結合の強さは,イオンの価数の積に比例し,イオンの中心間距離の2剰に反比例する(クーロン力F=k(q+q-)/r2に相当する)。
② ①と同様,Li+とNa+のイオン半径の違いで判断できる。イオン半径はLi+<Na+なので,結合力はLi2Oの方が強く融点
|
||||
 |
||||